焦点新闻
2022-06-09
2022asco | 恒瑞医药卡瑞利珠单抗联合阿帕替尼与注射用替莫唑胺一线治疗晚期肢端黑色素瘤研究亮相口头报告
2022年美国临床肿瘤学会(asco)年会上,北京大学肿瘤医院斯璐教授在皮肤与黑色素瘤专场作了口头报告(图1),介绍了北京大学肿瘤医院郭军教授团队一项卡瑞利珠单抗联合阿帕替尼与注射用替莫唑胺一线治疗晚期肢端黑色素瘤研究的最新进展。
研究结果显示,卡瑞利珠单抗联合阿帕替尼(“双艾”组合)和注射用替莫唑胺的联合疗法一线治疗晚期肢端黑色素瘤的客观缓解率达到66.7%,中位无进展生存期为18.4个月,有望为晚期肢端黑色素瘤患者带来新的治疗选择[1]。

图1.斯璐教授在2022asco年会作口头报告
肢端黑色素瘤亚型在亚洲占比高,亟需探索新的治疗方案
肢端黑色素瘤在欧美是一种比较罕见的黑色素瘤亚型,在所有黑色素瘤中仅占1%-7%;而在亚洲却有很大不同,占比达到50%以上,是一种常见的黑色素瘤亚型[2、3]。
目前,晚期肢端黑色素瘤没有标准治疗方法,在欧美作为晚期皮肤型黑色素瘤标准治疗的抗pd-1单克隆抗体单药,在亚洲肢端型患者中疗效却不尽人意[4],客观缓解率仅为14.0%-15.8%[5、6]。郭军教授团队前期探索了抗pd-1单抗与抗血管内皮生长因子受体药物的组合疗法,客观缓解率能提高至22.2%[7]。在免疫治疗时代,肢端黑色素瘤仍然缺乏有效的治疗手段。
“双艾“联合注射用替莫唑胺方案,治疗晚期肢端黑色素瘤取得重要突破
本次郭军教授团队入选2022asco年会口头报告的是一项卡瑞利珠单抗联合阿帕替尼和注射用替莫唑胺一线治疗晚期肢端黑色素瘤的ii期临床试验。旨在评价该组合疗法在晚期肢端黑色素瘤中的有效性及安全性。
研究纳入的主要人群为18-75岁的患有不可切除iii期或转移性的肢端黑色素瘤患者;晚期未接受过系统抗肿瘤治疗;体力状况ecog评分0-1分;braf v600野生型;至少具有一个实体瘤疗效评定标准1.1(recist 1.1)规定的可测量病灶。
研究的主要终点是客观缓解率(orr),次要终点包括无进展生存期(pfs)、疾病控制率(dcr)、总生存期(os)与安全性[1]。
截至2022年4月10日,本研究共纳入50名受试者,其中48名可评估疗效。确认的orr达到66.7%(完全缓解(cr)1人,部分缓解(pr)31人),dcr达到91.7%(图2)。
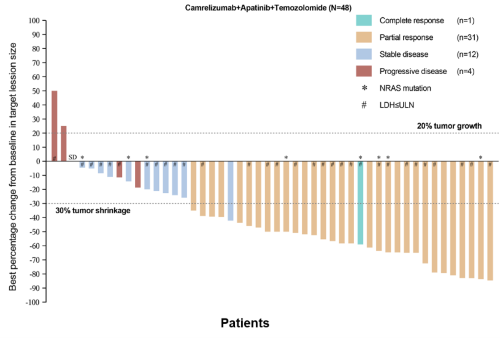
图2.受试者肿瘤缓解情况
中位至肿瘤缓解时间(time to response)为2.7个月,中位缓解持续时间(dor)17.5个月,有11人(22.9%)在第一次影像学评估时达到了pr(图3)[1]。
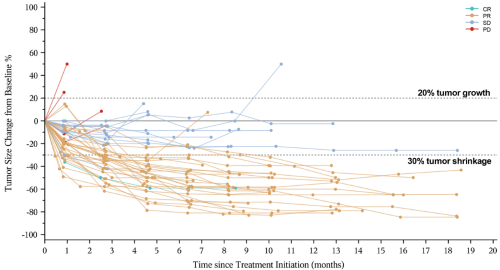
图3.不同受试者随时间变化的肿瘤负荷
中位治疗持续时间为9.2个月(图4)。在研究期间,5例患者的病灶变为可切除,因此他们停止了治疗并接受了手术;术后发现有1例患者达到病理缓解(pcr)。这5例患者中有4例(包括1例术前cr)仍无疾病进展,1例术后10个月疾病复发。
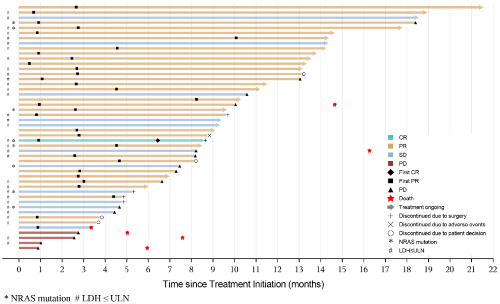
图4.受试者泳道图
本研究中位随访时间为14个月,6个月pfs率为84.8%,12个月pfs率为65.1%,中位pfs为18.4个月。12个月os率91.6%,中位os未达到(图5)[1]。
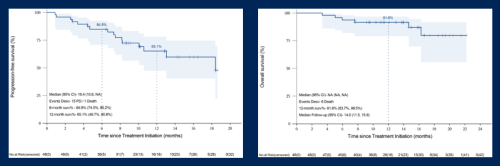
图5.pfs与os的k-m曲线
亚组分析发现,相较于基线时乳酸脱氢酶(ldh)升高的患者,基线时ldh正常的患者的os有获益趋势;达到pr的患者有较好的pfs和os(图6)。
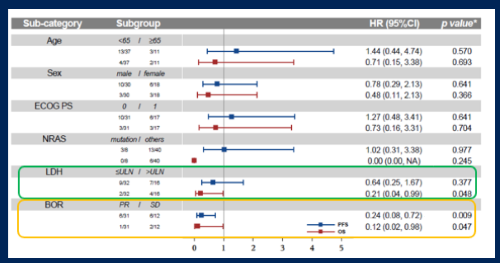
图6.亚组分析
卡瑞利珠单抗联合阿帕替尼和注射用替莫唑胺的三药联合方案在全球属于首创,其在一线治疗晚期肢端黑色素瘤的研究取得了令人振奋的结果。66.7%的客观缓解率超过了既往文献报道中其他任何肢端黑色素瘤中探索的药物组合[4],患者的无进展生存期显著提升,安全性可控。本研究的出色数据为肢端黑色素瘤一线治疗探索了新的可能,有望满足国际社会对于肢端黑色素瘤治疗方案的迫切需求。
恒瑞医药围绕健康中国推进创新研发致力惠及更多患者
值得一提的是,本研究所用的三种药物——卡瑞利珠单抗、甲磺酸阿帕替尼、注射用替莫唑胺均为恒瑞医药已上市产品,对于国内的肢端黑色素瘤患者而言,有较好的药物可及性,有望成为惠及我国肢端黑色素瘤患者的创新方案。本研究被选为2022asco年会的口头报告,也体现了由中国专家开展的临床研究和由中国药企研发的创新药物得到国际学界的关注与认可。
长期以来,恒瑞医药秉持“科技为本,为人类创造健康生活”的使命,聚焦广大患者特别是中国患者的需求,大力推进创新研发。目前,公司已有10个创新药获批上市,另有60多个创新药正在临床开发。未来,恒瑞医药将持续实施科技创新和国际化双轮驱动战略,努力研制更多新药、好药,服务健康中国、惠及全球患者。
参考资料:
[1]. 2022 asco, oral abstract session 9508
[2]. namikawa k, et al. curr treat options oncol. 2019;20(1):7.
[3]. desai a, et al. clin exp dermatol. 2017;42(8):845-848.
[4]. mao l, et al. front immunol. 2021;12:680407.
[5]. tang b, et al. clin cancer res. 2020;26(16):4250-4259.
[6]. si l, et al. transl oncol. 2019;12(6):828-835.
[7]. wang x, et al. j clin oncol. 2021;39(15_suppl):9539.
撰稿:张程
责任编辑:张雷