焦点新闻
2023-05-13
喜讯!恒瑞创新药达尔西利乳腺癌研究成果荣登《柳叶刀 · 肿瘤学》
5月12日,达尔西利联合来曲唑或阿那曲唑一线治疗hr /her2-晚期乳腺癌的ⅲ期dawna-2研究期中分析结果全文在线发表于国际肿瘤学领域顶级期刊《柳叶刀·肿瘤学》(the lancet oncology,影响因子:54.433)[1]。中国医学科学院肿瘤医院徐兵河院士牵头开展该研究。
达尔西利是恒瑞医药自主研发的cdk4/6抑制剂。dawna-2研究在期中分析时达到其主要终点。达尔西利 来曲唑/阿那曲唑的中位无进展生存(pfs)为30.6个月,刷新晚期一线pfs数据。dawna-2研究的期中分析结果使达尔西利 来曲唑/阿那曲唑有望成为hr /her2-晚期乳腺癌患者一线治疗的新选择。

在ⅲ期dawna-1研究[2]中,达尔西利联合氟维司群在hr /her2-晚期乳腺癌内分泌治疗后进展的患者中展现出pfs的显著改善。dawna-2(nct03966898)是一项多中心、随机对照、双盲的ⅲ期临床试验,旨在评估达尔西利联合来曲唑或阿那曲唑作为hr /her2−晚期乳腺癌患者一线治疗的疗效和安全性。
研究设计
dawna-2研究入组标准为:1)病理证实的hr /her2-局部晚期或转移性乳腺癌;2)ecog体能状态(ps)评分为0或1;3)任何绝经状态;4)既往未接受过cdk4/6抑制剂治疗;5)未接受过针对晚期疾病的系统性治疗;6)根据recist1.1标准有可测量病灶或不可测量的仅骨转移病灶(包括溶骨性病灶或混合溶骨/成骨病灶)。
456例患者按照2:1比例随机分组接受达尔西利 来曲唑/阿那曲唑(302例)或安慰剂 来曲唑/阿那曲唑(153例)治疗。达尔西利150mg口服,每日1次,用药3周之后停药1周,每4周为一个周期;来曲唑每日2.5mg,口服;阿那曲唑每日1mg,口服。
主要研究终点是研究者评估的pfs(预设单侧p≤0.0076为优效)。次要研究终点为盲法独立审查委员会(birc)评估的pfs、总生存(os)、客观缓解率(orr)、临床获益率(cbr)、缓解持续时间(dor)和安全性。根据内脏转移(是vs否)、既往(新)辅助接受内分泌治疗(是vs否)和试验中联用何种非甾体类芳香化酶抑制剂(来曲唑vs阿那曲唑)对患者进行分层。
患者基线特征
dawna-2入组人群全部为中国患者。达尔西利组和对照组的基线特征均衡,中位年龄分别为54岁(范围,47~63岁)和57岁(范围,46~63岁),两组均有约20%的患者年龄≥65岁。ecog ps评分为1的患者占比为53%和55%。达尔西利组入组约40%的绝经前/围绝经期患者,60%的绝经后患者,对照组的数据分别为35%和65%。大多数患者的雌激素受体(er)/孕激素受体(pr)均为阳性(85% vs 88%),少数患者pr阴性(15% vs 12%)。绝大多数患者有可测量病灶(92% vs 93%),转移灶数量≥3的患者分别占47%和48%。两组的新发转移患者比例为41%和42%,无病间期>24个月的患者均占52%,均有61%的患者被发现有内脏转移,分别有30%和31%的患者接受过新辅助内分泌治疗。
研究结果
刷新晚期一线pfs数据,首次突破30个月
dawna-2研究在期中分析时达到其主要终点。达尔西利 来曲唑/阿那曲唑的中位pfs为30.6个月(95% ci: 30.6-未达到[nr]),安慰剂 来曲唑/阿那曲唑为18.2个月(95% ci: 16.5-22.5),联合达尔西利治疗延长了12.4个月的pfs,降低疾病进展或死亡风险49%(hr=0.51;95% ci: 0.38-0.69,p<0.0001)。研究者评估的pfs与birc评估的pfs相似(nr vs 22.5个月,hr=0.50)。
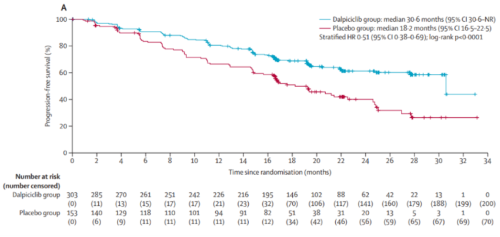
研究者评估的pfs
birc评估的pfs
攻坚内脏转移,绝经前/后亚组全面获益
除了无病间期≤24个月的患者,达尔西利联合治疗在其余所有亚组获得与总人群一致的pfs获益趋势。在占比约60%的内脏转移患者中,达尔西利降低患者的疾病进展或死亡风险37%(hr=0.63;95%ci: 0.43-0.90),非内脏转移亚组pfs hr为0.37(95%ci: 0.23-0.61)。
pfs亚组分析
中国乳腺癌患者较欧美患者更为年轻,约有60%的患者在确诊时为绝经前状态[3、4]。dawna-2研究显示,达尔西利联合非甾体类芳香化酶抑制剂一线治疗在不同绝经状态患者中的pfs获益一致。在绝经前/围绝经期患者中,达尔西利组和对照组的中位pfs分别为nr (95% ci: 27.7-nr) 和16.6个月 (95% ci: 12.9-27.7),达尔西利组降低疾病进展或死亡风险47%(hr=0.53;95%ci: 0.33-0.85;p=0.0039)。在绝经后患者中,达尔西利组和对照组的中位pfs分别为30.6个月 (95% ci: 24.9-nr)和19.4个月 (95% ci: 16.6-24.6),达尔西利组降低疾病进展或死亡风险48%(hr=0.52;95%ci: 0.36-0.75;p=0.0002)。
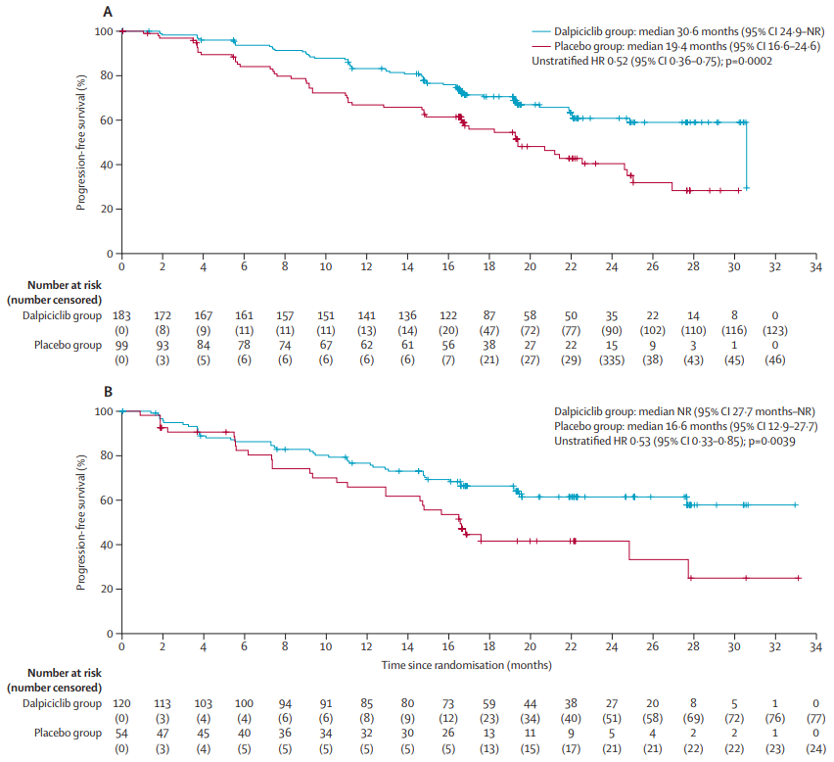
研究者评估的绝经后(a)和绝经前/围绝经期(b)患者的pfs
orr新突破,彰显抗肿瘤活性
研究者评估的达尔西利组与对照组的orr分别为57% (95% ci: 52%-63%)和48% (95% ci: 40%-56%) (p=0.023)。达尔西利组2例(<1%)患者达到完全缓解(cr),57%的患者达到部分缓解(pr),29%的患者达到疾病稳定(sd)。在对照组没有cr患者,48%的患者达到pr, 39%达到sd。两组的cbr分别为87% (95% ci: 83%-90%) 和80% (95% ci: 73%-86%),中位dor分别为nr和15.0个月。
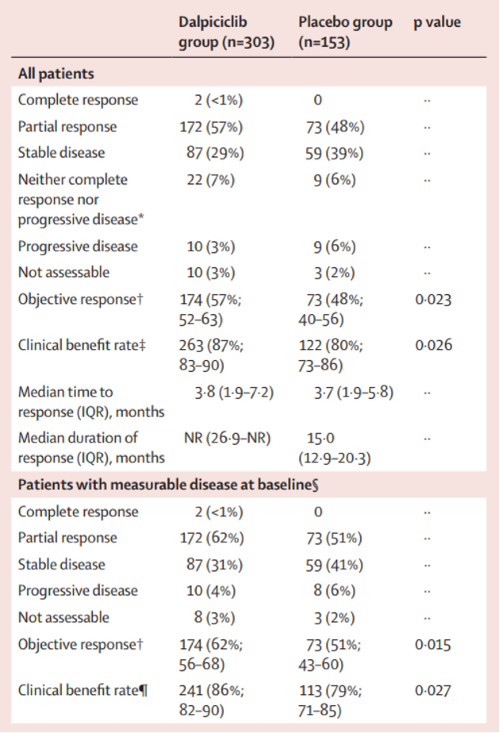
研究者评估的肿瘤缓解情况
安全性易于管理,提高患者生活质量
dawna-2研究中达尔西利的不良反应与既往研究中报道的相似,并未出现新的安全性事件。因不良反应减量(32%)和中断治疗的比例较低(4%),显示达尔西利有较好的耐受性。
研究组的主要不良反应为血液学不良反应。其类型单一,易处理,并且与cdk4/6抑制剂的已知不良反应一致。
关于非血液学不良事件,达尔西利的肝毒性很小,这可能得益于达尔西利特有的结构优化。
研究组的可感知副作用较小,如腹泻发生率较低且未观察到3/4级腹泻,有利于提高患者的用药依从性。
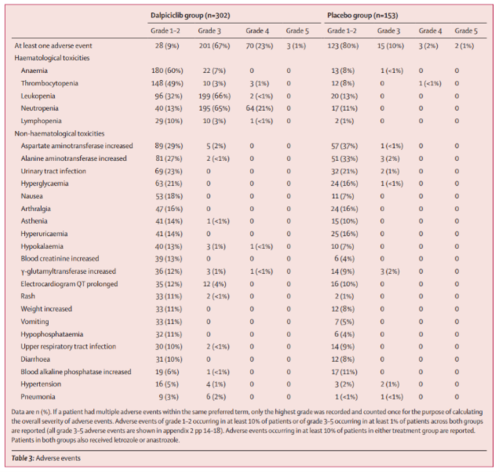
血液学毒性和非血液学毒性
研究结论
dawna-2研究在期中分析时达到其主要终点,与安慰剂 来曲唑/阿那曲唑相比,达尔西利 来曲唑/阿那曲唑显著改善pfs。达尔西利 来曲唑/阿那曲唑的安全性易于管理。dawna-2研究的期中分析结果使达尔西利 来曲唑/阿那曲唑有望成为hr /her2-晚期乳腺癌患者一线治疗的新选择。
达尔西利于2023年1月18日正式被纳入国家医保药品目录。2023年3月1日,新版国家医保药品目录正式落地执行,达尔西利进入医保后将大幅降低药物临床应用的“经济门槛”,以更高的可负担性,惠及更多晚期乳腺癌患者。
参考文献:
1. zhang p, et al. dalpiciclib plus letrozole or anastrozole versus placebo plus letrozole or anastrozole as first-line treatment in patients with hormone receptor-positive, her2-negative advanced breast cancer (dawna-2): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. lancet oncol. published online may 11, 2023.
2. xu b, et al. dawna-1 study consortium. dalpiciclib or placebo plus fulvestrant in hormone receptor-positive and her2-negative advanced breast cancer: a randomized, phase 3 trial. nat med. 2021 nov;27(11):1904-1909.
3. fan l, et al. breast cancer in china. lancet oncol, 2014, 15(7): e279-e289.
4. 中国早期乳腺癌卵巢功能抑制临床应用专家共识(2021年版)[j].中国癌症杂志,2022,32(02):177-190.