焦点新闻
2023-06-07
2023 asco年会 | 恒瑞创新药shr-1701联合shr2554治疗经治的晚期淋巴瘤和实体瘤患者ⅰ期研究亮相口头报告
正在进行的2023年美国临床肿瘤学会(asco)年会上,由中国人民解放军总医院韩为东教授、丰恺超教授团队开展的“双功能抗pd-l1/tgf-βrii药物shr-1701联合ezh2抑制剂shr2554治疗经治的晚期淋巴瘤和实体瘤患者ⅰ期研究”入选口头报告。研究结果显示,shr-1701联合shr2554在既往接受过免疫疗法的经典型霍奇金淋巴瘤(chl)患者中显示出可控的安全性和令人鼓舞的抗肿瘤活性,尤其是在可评估的chl患者中,客观缓解率达到100%[1]。

双功能抗pd-l1/tgf-βrii药物shr-1701联合ezh2抑制剂shr2554治疗经治的晚期淋巴瘤和实体瘤患者ⅰ期研究结果在asco 2023会上发布
研究背景
尽管肿瘤免疫治疗取得了显著进展,但大多数患者只是获得了部分缓解,并且大多数患者最终会发生疾病进展。既往研究已经证明,去甲基化药物地西他滨(表观遗传学药物)联合卡瑞利珠单抗(抗pd-1单抗)在复发/难治性chl患者中可以逆转pd-1单抗的耐药性。ezh2作为肿瘤治疗的一个表观遗传学靶点,基础研究已证实其可以增强抗原递呈并与免疫治疗联合能协同增效。该研究探讨了shr-1701(抗pd-l1/tgf-βrii)联合shr2554(ezh2抑制剂)在经治复发/难治性淋巴瘤和实体瘤患者中的安全性和有效性。
shr-1701是恒瑞医药自主研发并具有知识产权的抗pd-l1/tgf-βrii双功能融合蛋白,可以促进效应性t细胞的活化,同时还可有效改善肿瘤微环境中的免疫调节作用,最终有效促进免疫系统对于肿瘤细胞的杀伤。shr2554是恒瑞医药开发的新型、高效、选择性的口服ezh2抑制剂,可以选择性抑制野生型和突变型ezh2酶活性。今年年初,shr2554治疗复发/难治外周t细胞淋巴瘤被国家药品监督管理局药品审评中心纳入突破性治疗品种名单。两款创新药均已实现海外授权。
研究设计
这是一个开放标签、单臂、研究者发起的剂量递增和扩展1期研究(nct04407741)。主要入选标准为:1) 晚期实体瘤或复发/难治性淋巴瘤;2) ecog ps评分0-1 ;3) 实体瘤:转移后接受≥1线治疗;4) 淋巴瘤:既往接受≥2线治疗;5) 足够的器官功能;6) ≥1个可测量病灶;7) 允许既往接受过抗pd-1/pd-l1单抗或ctla-4抑制剂治疗。
剂量递增期评估了shr2554(300~350mg bid)的递增剂量加固定剂量shr-1701(30mg/kg q3w)。
剂量扩展期,给予shr2554的推荐ⅱ期剂量(rp2d)加shr-1701。主要研究终点是rp2d,次要终点是安全性和客观缓解率(orr)。
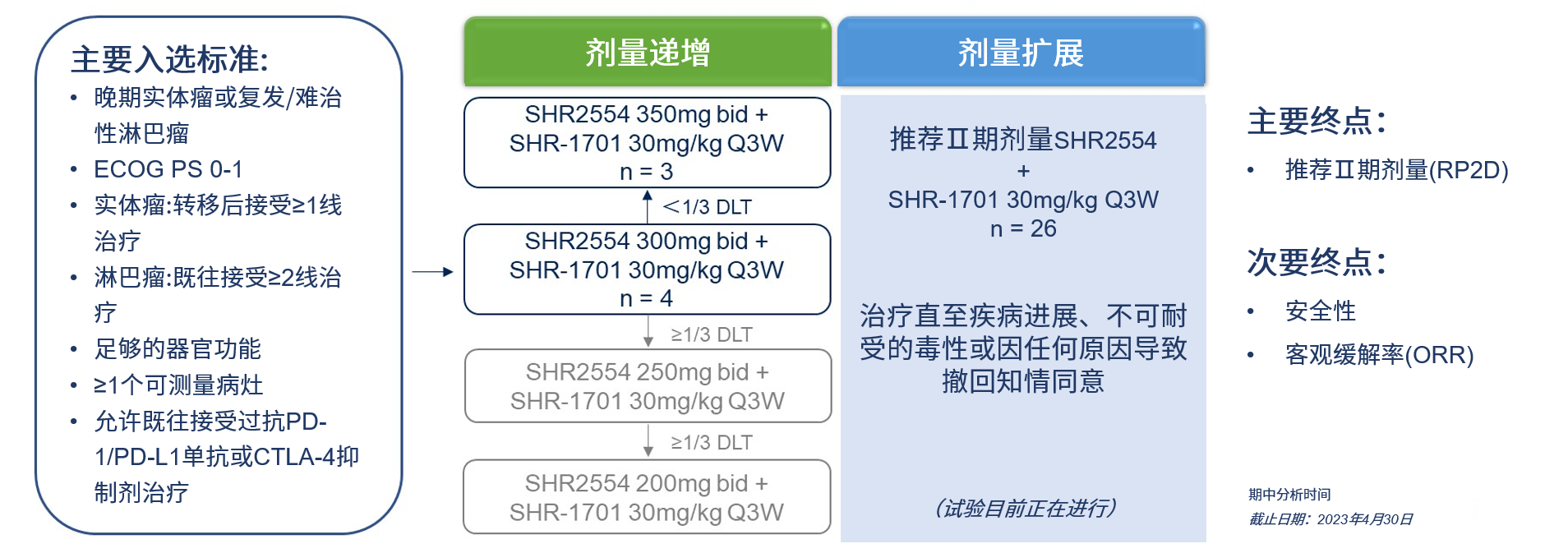
研究设计
研究结果
截至2023年1月6日,已入组33例患者(剂量递增:n=7;剂量扩展:n=26)。未观察到剂量限制性毒性,并确定rp2d为shr2554 350mg bid加shr-1701 30mg/kg q3w。
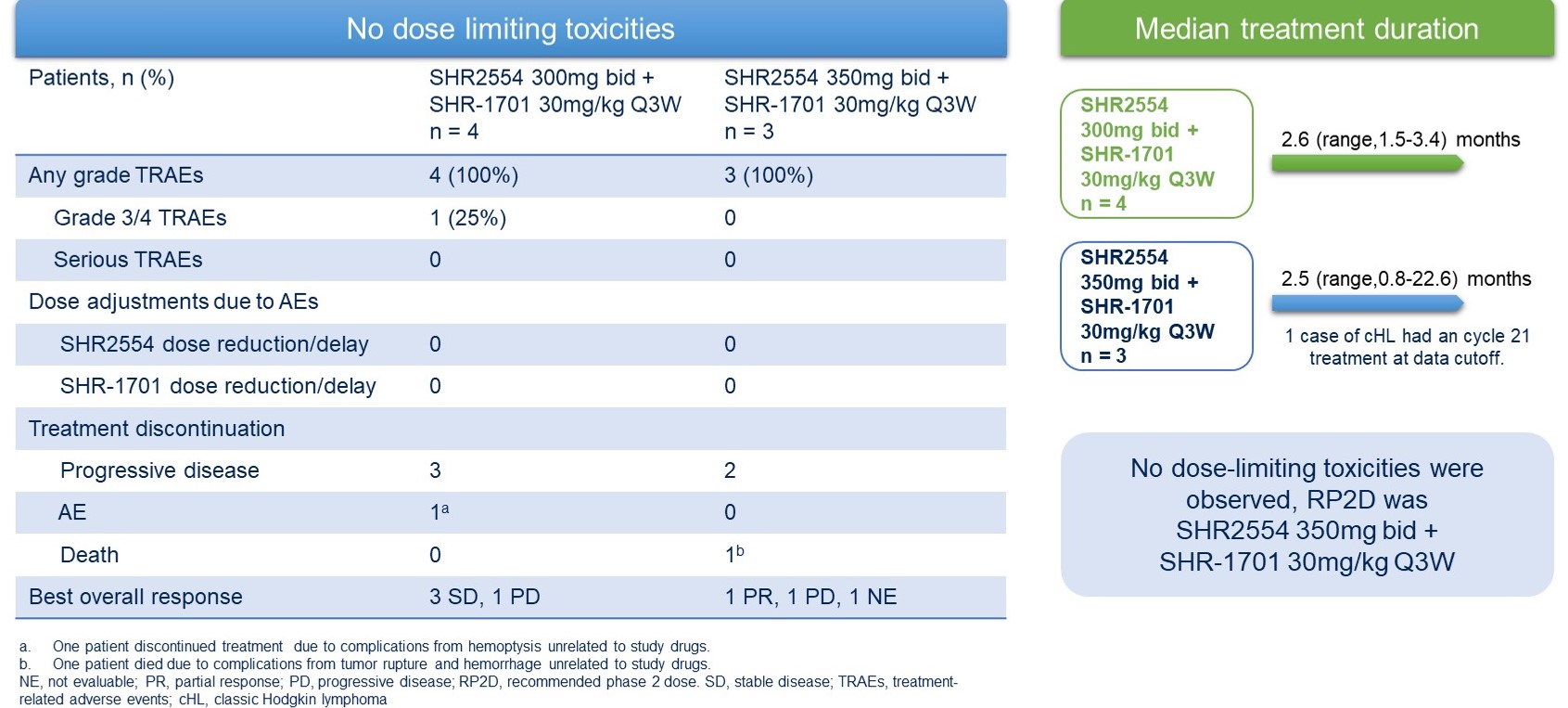
推荐ⅱ期剂量
在26例可评估疗效的人群中,客观缓解率(orr)为57.7%,其中2例完全缓解(cr),1例为转移性肾细胞癌患者,另1例为chl患者。
研究入组了16例既往接受中位10线治疗的复发/难治性chl患者,所有的16(100%)例chl患者既往接受过抗pd-1/pd-l1抗体治疗,15例(93.8%)既往接受过去甲基化治疗,如地西他滨或西达本胺。在疗效可评估的14例chl患者中,orr为100%,cr率为7.1%。
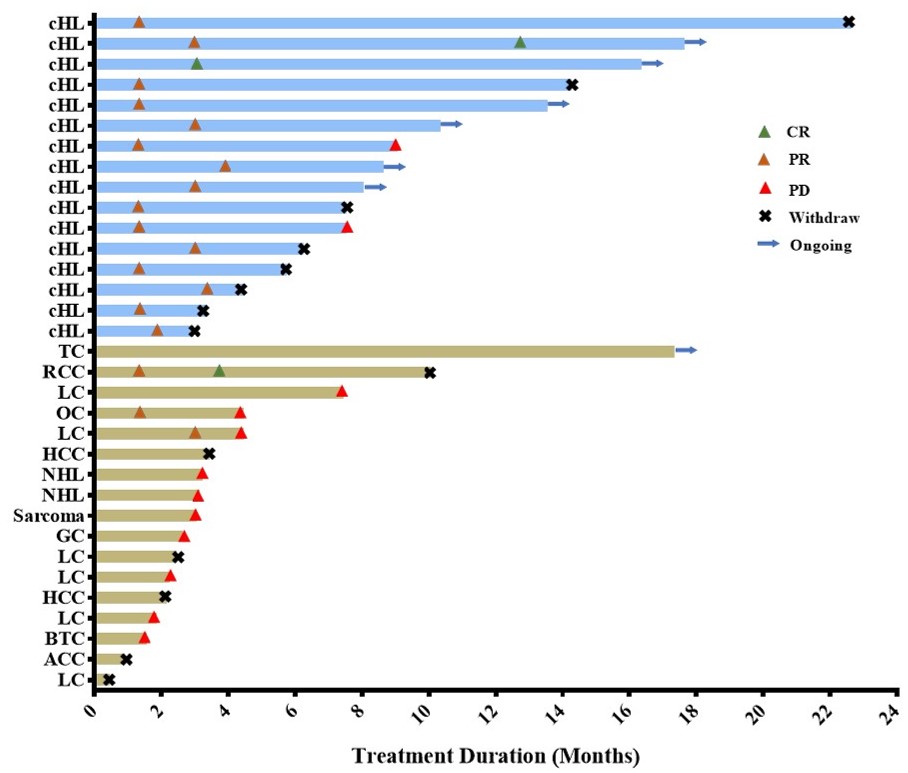
治疗时间
研究结论
这是第一项研究抗pd-l1/tgf-βrii药物联合ezh2抑制剂对复发/难治性淋巴瘤和实体瘤患者的安全性和有效性的前瞻性研究。该研究初步结果显示,shr-1701联合shr2554在既往接受过免疫治疗的chl患者中显示出可接受的安全性特征以及令人鼓舞的抗肿瘤活性。该结果为进一步的探索奠定了基础。
作为一家聚焦抗肿瘤等重大疾病领域进行新药研发的创新型国际化制药企业,恒瑞医药近些年面向民生需求,加大原创新药研发力度,目前已有12款自研创新药和1款引进创新药获批上市。2023年asco年会上,恒瑞医药共有8款抗肿瘤创新药的57项研究登台亮相。面向未来,恒瑞医药将持续创新,研发满足老百姓健康需求的高质量药物,为健康中国做出贡献,并造福全球患者。
参考资料:
[1]. 2023 asco oral 2507