焦点新闻
2023-07-28
恒瑞创新药阿得贝利单抗食管鳞癌研究成果登上《自然医学》
7月25日,恒瑞医药创新药阿得贝利单抗(艾瑞利®)单药用于新辅助治疗局部晚期可切除食管鳞癌的1b期试验(naiton-1907研究)发表在国际顶级学术期刊《自然》子刊《自然医学》(nature medicine)(if=82.9),该研究由复旦大学附属中山医院胸外科谭黎杰教授、尹俊教授团队联合华大生命科学研究院共同开展。研究结果显示,局部晚期可切除食管鳞癌(escc)接受阿得贝利单抗单药两周期新辅助治疗序贯手术,安全性良好。主要病理缓解(mpr)率为24%,病理完全缓解(pcr)率为8%,2年总生存期(os)率为92%,2年无复发生存期(rfs)率达100%。本研究为阿得贝利单抗单药新辅助治疗可切除escc患者提供了依据[1]。

naiton-1907研究在线发表于nature medicine
研究背景
近年来,以免疫检查点抑制剂为代表的免疫治疗在多种晚期实体瘤中获得积极的治疗效果,并逐渐从后线维持治疗向新辅助治疗阶段应用。新辅助免疫治疗通过在术前激活肿瘤浸润t淋巴细胞,使其克隆扩增,达到对微转移灶的监测和清除,降低术后远处复发[2]。然而针对escc进行新辅助免疫单药治疗的安全性与获益情况尚未见报道,同时缺乏明确有效的生物标志物用于预示escc免疫治疗的疗效。免疫治疗已经在晚期escc一线和二线治疗中取得显著疗效,但仍未获批局晚期可手术escc适应症[3、4]。局部晚期escc的治疗需求未得到满足,新的治疗策略仍待探索。
本研究是一项单臂、前瞻性、1b期试验(nation-1907研究),首次探索抗pd-l1单克隆抗体阿得贝利单抗新辅助治疗可切除escc的安全性和初步疗效,并探索敏感/耐药机制、疗效预测的生物标志物、治疗期间肿瘤微环境的变化,为选择适合免疫治疗人群的个性化治疗提供证据。
研究方法
本研究纳入ct2-4an0-2m0(ajcc 第8版)可切除食管鳞癌患者。患者接受两个周期的阿得贝利单抗治疗,每3周第一天静脉滴注,20mg/kg,3周为一个周期。两个周期治疗后行手术切除。收集肿瘤组织和外周血进行全外显子组测序(wes)、bulk rna测序(rna-seq)、t细胞受体测序(tcr-seq),并与病理缓解进行相关性分析。研究主要终点是安全性、可行性,次要终点包括病理完全缓解(pcr)、总生存期(os)、无复发生存期(rfs)、r0 切除率,探索性终点包括肿瘤缓解与pd-l1状态、tme、基因表达相关性(图1)。
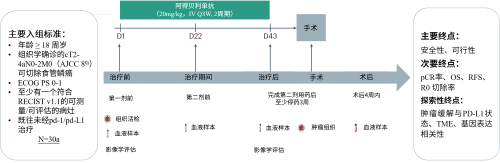
图1.研究设计
研究结果
1阿得贝利单抗治疗局部晚期escc具有良好的可行性和安全性
2019年12月26日至2020年8月29日期间,共有30例患者入组并接受研究药物治疗。2例患者撤回知情,3例患者因covid-19未完成方案治疗,最终25例患者完成2周期新辅助治疗并行手术切除,未出现手术延迟。
研究未出现新的安全性信号。14例患者(56%, 14/25)发生治疗相关的不良反应(traes)多数为轻度。阿得贝利单抗末次用药与手术的中位间隔时长为26天(范围:22-55天)。23例患者实现r0切除,2例患者未实现r0切除。
2阿得贝利单抗治疗局部晚期escc显示出较好的肿瘤缓解
术后病理评估显示,11例缓解良好,其中6例(24%)mpr(肿瘤细胞残留≤10%),2例(8%)pcr(无肿瘤细胞残留),5例ppr(肿瘤细胞残留10%~33%)(图2)。13例(52%)较治疗前实现肿瘤降期。
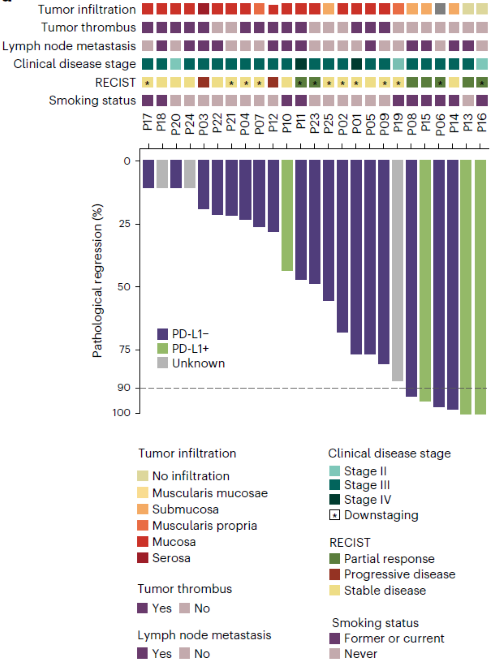
图2. 病理缓解情况
3阿得贝利单抗治疗局部晚期escc具有生存获益
25例患者经手术切除后,12例未行治疗,13例行术后辅助治疗,治疗方案包括化疗、放化疗、免疫治疗。截至研究cut-off日期(2022年8月15日),中位随访时长27个月(范围:24–31个月),2年os率为92%(95%ci 82%-100%),2年rfs率达100%。
将本研究的os、rfs与新辅助化疗/放化疗历史对照研究(cmisg1701研究[5])进行事后比较分析。经逆概率加权校正后,本研究2年rfs率为100%,较ncrt组61%有统计学显著提升(hr 0.04,95%ci 0.01-0.33;p=0.002),较nct组63%同样有统计学显著改善(hr 0.05,95% ci 0.01-0.37;p=0.003)。同样,经加权校正后本研究2年os率为94%,较ncrt组69%有统计学显著改善(hr 0.17,95% ci 0.04-0.76;p= 0.021),较nct组67%同样有统计学显著改善(hr 0.13,95% ci 0.03-0.59;p= 0.008)(图3)。
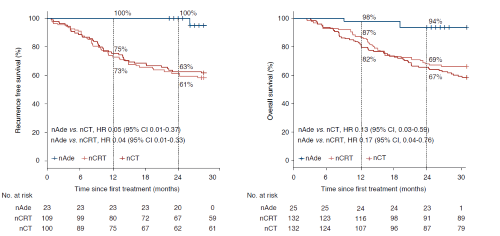
图3. 本研究与历史对照nct或ncrt患者rfs、os的km曲线比较
4探索疗效预测的生物标志物、治疗期间肿瘤微环境的变化与病理退缩的相关性
本研究探索了疗效预测的生物标志物、治疗期间肿瘤微环境的变化与病理退缩的相关性。发现治疗反应良好的人群在基线时呈现免疫富集的肿瘤微环境表型,而治疗反应差的人群多呈现成纤维细胞富集型;且肿瘤内t细胞克隆动态变化可用于识别治疗反应良好的人群。
研究结论
免疫单药阿得贝利单抗新辅助治疗局部晚期可切除escc显示出良好的安全性和可行性。治疗反应良好的人群在基线时呈现免疫富集的肿瘤微环境表型,而治疗反应差的人群多呈现成纤维细胞富集型。肿瘤内t细胞克隆动态变化可用于识别治疗反应良好的人群。本研究为阿得贝利单抗单药新辅助治疗可切除escc患者提供了依据。
关于阿得贝利单抗
本研究使用的试验药物阿得贝利单抗是恒瑞医药自主研发的人源化抗pd-l1单克隆抗体,是中国首个获批小细胞肺癌适应症的自主研发pd-l1抑制剂,打破了3年来进口pd-l1抑制剂产品在治疗广泛期小细胞肺癌领域的垄断地位,于2023年3月获批上市,联合卡铂和依托泊苷用于广泛期小细胞肺癌(es-sclc)患者的一线治疗。该产品已被北京、上海、成都等多地纳入“惠民保”特药报销目录。
作为根植中国的创新型国际化制药企业,恒瑞医药近十年累计研发投入292亿元,位居全国医药行业前列。公司还在连云港、上海、美国和欧洲等地设立14个研发中心,全球研发团队达5000余人。公司不断丰富创新药布局,除持续深耕肿瘤领域外,还在代谢性疾病、感染疾病、自身免疫疾病、疼痛管理、心血管疾病等方面发力,目前已获批上市13款自研创新药、2款合作引进创新药。未来,恒瑞医药将继续深入践行“科技为本、为人类创造健康生活”的使命,重创新,强研发,力争研制出更多更好的新药,服务健康中国,惠及全球患者。
参考文献
[1].yin j, yuan j, li y, et al. neoadjuvant adebrelimab in locally advanced resectable esophageal squamous cell carcinoma: a phase 1b trial [published online ahead of print, 2023 jul 24]. nat med. 2023;10.1038/s41591-023-02469-3. doi:10.1038/s41591-023-02469-
[2].versluis, j. m., long, g. v. & blank, c. u. learning from clinical trials of neoadjuvant checkpoint blockade. nat. med. 26, 475–484 (2020).
[3].xu, j. et al. tislelizumab plus chemotherapy versus placebo plus chemotherapy as first-line treatment for advanced or metastatic oesophageal squamous cell carcinoma (rationale-306): a global, randomised, placebo-controlled, phase 3 study. lancet oncol. 24, 483–495 (2023).
[4].kojima, t. et al. randomized phase iii keynote-181 study of pembrolizumab versus chemotherapy in advanced esophageal
cancer. j. clin. oncol. 38, 4138–4148 (2020).
[5].wang, h., li, s., liu, t., chen, j. & dang, j. neoadjuvant immune checkpoint inhibitor in combination with chemotherapy or chemoradiotherapy in resectable esophageal cancer: a systematic review and meta-analysis. front. immunol. 13, 998620 (2022).