新闻速递
2023-10-23
2023esmo口头报告|“双艾”组合又有新突破,全球首个胃癌围术期靶免联合iii期研究结果重磅发布
2023年欧洲肿瘤内科学会(esmo)年会已于10月20日在西班牙马德里盛大开幕。作为全球最负盛名和最具影响力的肿瘤学会议之一,口头报告专场将发布最新的高质量研究数据,全球专家进行讨论和观点分享。
10月21日,恒瑞医药创新药卡瑞利珠单抗(艾瑞卡®)联合阿帕替尼(艾坦®)(“双艾”组合)和化疗对比化疗治疗局部进展期胃癌随机对照ⅲ期试验(dragon-iv/ahead-g208研究)在大会简短口头(mini oral)报告环节正式亮相,该研究由上海交通大学医学院附属瑞金医院朱正纲教授担任主要研究者,上海交通大学医学院附属瑞金医院李琛教授在现场公布了该重磅研究的相关数据1。该项研究为全球首个胃癌围术期靶免联合iii期研究,结果显示,卡瑞利珠单抗联合阿帕替尼和化疗组病理完全缓解(pcr)率为18.3%,显著高于化疗组的5.0%,达到主要终点,为我国自主研发的pd-1单抗和选择性vegfr2抑制剂——卡瑞利珠单抗和阿帕替尼在胃癌领域的治疗再添力证!

李琛教授现场照片(右一)
研究背景
局部进展期胃或胃食管结合部腺癌围手术期推荐使用化疗,其中sox方案(奥沙利铂 替吉奥)为首选,但5年总生存(os)率仍较低2。卡瑞利珠单抗联合阿帕替尼已在多个实体瘤中证实有协同作用3-6。
本次esmo公布的dragon-iv/ahead-g208研究为一项全国多中心,随机对照开放标签的ⅲ期试验,旨在进一步验证卡瑞利珠单抗联合阿帕替尼和化疗对比化疗在局部进展期胃或胃食管结合部腺癌围术期的疗效和安全性。
研究设计
本项研究计划招募512例初始可切除的t3-4an m0胃癌或胃食管结合部腺癌患者,按1:1的比例随机分配到soxrc组(sox联合卡瑞利珠单抗联合阿帕替尼)或sox组。根据原发灶位置(胃 vs. 胃食管结合部)和bulky n(是 vs. 否)进行分层。患者术前分别接受3个周期的卡瑞利珠单抗 阿帕替尼 sox或sox,随后进行胃癌d2根治术。术后soxrc组接受3个周期的卡瑞利珠单抗 阿帕替尼 sox,和卡瑞利珠单抗 阿帕替尼维持治疗(卡瑞利珠单抗术前术后最多使用17个周期,阿帕替尼术前术后总治疗时长不超过一年),sox组进行3个周期的sox,和s-1维持治疗(总治疗时长不超过一年)。主要终点是盲态独立评审委员会(birc)评估的病理完全缓解(pcr)率(ypt0)和研究者评估的无事件生存期(efs),次要终点为tpcr (ypt0n0)、主要病理缓解(mpr)、r0切除率、ypn分期、无病生存期(dfs)、os和安全性。
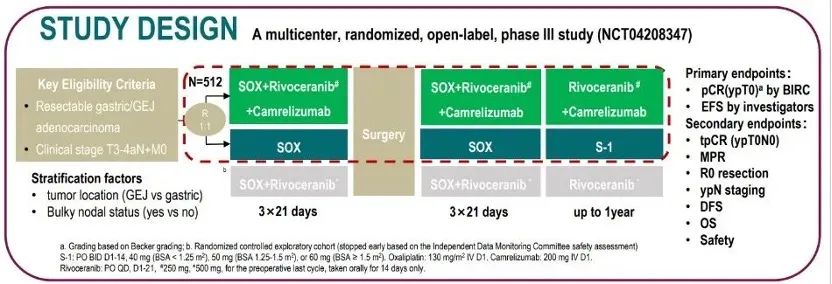
图1.研究设计
研究结果
1. 新辅助完成率和pcr率• 自2019年12月18日至2022年12月31日,soxrc组和sox组各入组180例。数据截止日期为2023年4月19日。
• soxrc组新辅助完成率为91.1%,sox组新辅助完成率为93.9%;
• soxrc组手术完成率为86.1%,sox组手术完成率为86.7%;
• 意向治疗(itt)人群中soxrc组pcr率为18.3%(95% ci 13.0-24.8),较sox组5.0%(95% ci 2.3-9.3)显著提高13.7%(95% ci 7.2-20.1,p<0.0001),具有统计学显著差异;soxrc组ypt0n0率为16.7%,sox组为4.4%;soxrc组mpr率为51.1%,sox组mpr率为37.8%;
• 行手术治疗的人群中,soxrc组和sox组pcr率分别为21.3%和5.8%,r0切除率分别为98.7%和94.2%。
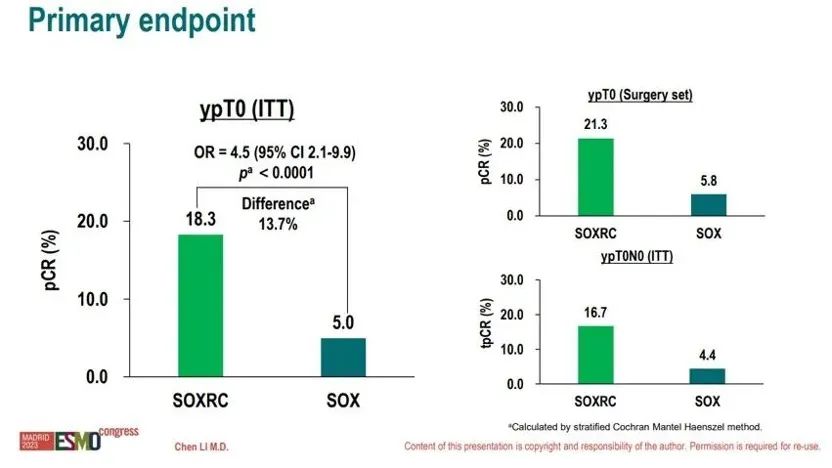
图2.主要研究终点
表1.新辅助完成情况及手术情况
2. 亚组分析• 亚组分析显示,soxrc组在所有亚组中均获益。
表2.亚组分析
3. 安全性分析• 在化疗基础上加卡瑞利珠单抗和低剂量阿帕替尼,安全性可控,且未影响手术可行性。
总 结
• dragon-iv/ahead-g208研究是全球首个评估围手术期免疫联合抗血管生成药物和化疗治疗可切除胃癌或胃食管结合部腺癌的iii期临床试验;
•卡瑞利珠单抗联合阿帕替尼和化疗组pcr 18.3%,显著高于化疗组的5.0%,p<0.0001。研究仍在继续,待efs数据成熟;
•在化疗基础上加卡瑞利珠单抗和低剂量阿帕替尼,安全性可控,且未影响手术可行性;
•卡瑞利珠单抗联合阿帕替尼和化疗为可切除胃癌和胃食管结合部腺癌患者围术期治疗提供了安全可行的新选择。
“双艾”组合多点发力
恒瑞用创新护佑生命健康
卡瑞利珠单抗是恒瑞医药自主研发的一款人源化pd-1单克隆抗体,于2019年5月获批上市,目前已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤种中获批了9个适应症,其中8个适应症已纳入国家医保目录,为获批适应症和覆盖瘤种数量领先的国产pd-1产品。
阿帕替尼是恒瑞医药开发的一款针对血管内皮生长因子受体(vegfr)的小分子酪氨酸激酶抑制剂,于2014年10月获批上市,目前有3个适应症获批,分别为单药用于晚期胃腺癌或胃-食管结合部腺癌、既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌、联合卡瑞利珠单抗用于不可切除或转移性肝细胞癌。
卡瑞利珠单抗(艾瑞卡®)联合阿帕替尼(艾坦®)(“双艾”组合)已于今年初获得国家药监局(nmpa)批准用于一线治疗晚期肝细胞癌,这也是全球首个获批的用于治疗晚期肝细胞癌的pd-1抑制剂与小分子抗血管生成药物组合,为广大肝癌患者带去了治疗新希望。今年7月,“双艾”组合肝癌一线治疗适应症美国申报上市获fda受理。
除了在肝癌、胃癌治疗领域,“双艾”组合还在食管癌、黑色素瘤、子宫内膜癌和肺癌等不同瘤种进行研究,分别取得积极成果,亮相国际舞台。未来,“双艾”组合将继续在更广泛癌种治疗的探索中前行,有望造福更多肿瘤患者。本次esmo大会将持续发布这两款创新药在其他瘤种领域的最新研究结果,敬请关注。未来,恒瑞医药将继续坚持“以患者为中心”的理念,在聚焦未获满足的临床需求基础上,针对中国高发肿瘤领域持续推进创新研发,力争研制出更多更好的新药、好药,服务健康中国,惠及全球患者。
参考文献:
1. esmo 2023. abstract 1512mo.
2. lancet oncol. 2021 aug;22(8):1081-1092.
3. j clin oncol. 2020 dec 1;38(34):4095-4106.
4. lancet gastroenterol hepatol. 2022 mar;7(3):245-253.
5. lancet oncol. 2021 nov;22(11):1609-1617.
6. lancet. 2023 jul 24;s0140-6736(23)00961-3.