新闻速递
2023-10-22
2023esmo优选口头报告︱恒瑞医药卡瑞利珠单抗一项ⅲ期研究发布,有望为直肠癌治疗提供新策略
2023年欧洲肿瘤内科学会(esmo)年会已于10月20日在西班牙马德里盛大开幕。其中late-breaking abstract(lba)研究作为esmo年会的重中之重,将为临床实践提供重要参考。
10月21日,恒瑞医药创新药卡瑞利珠单抗(艾瑞卡®)的一项研究“新辅助短程放疗序贯卡瑞利珠单抗联合化疗对比长程放化疗序贯化疗治疗局部晚期直肠癌”随机对照ⅲ期试验(union) 以优选口头报告的形式正式亮相。该研究由华中科技大学同济医学院附属协和医院张涛教授、陶凯雄教授担任主要研究者,华中科技大学同济医学院附属协和医院林振宇教授在马德里现场报告了该重磅研究的结果1,此项研究是全球首个评估短程放疗序贯免疫治疗联合化疗治疗局部晚期直肠癌的ⅲ期研究,已达到主要终点病理完全缓解(pcr),有望为直肠癌患者的治疗提供新策略。

2023 esmo现场图:林振宇教授进行报告
研究背景
短程放疗(scrt)或长程放化疗(lcrt)联合化疗已被推荐为局部晚期直肠癌(larc)的标准新辅助治疗2-4,但预后仍需进一步改善。为了探索更有效的治疗方法,研究者之前进行了一项单臂ii期试验,scrt序贯pd-1抑制剂卡瑞利珠单抗(cam)联合化疗治疗larc。研究结果显示出令人鼓舞的pcr率(48.1%),具有可接受的安全性和良好的耐受性5。这项ⅲ期试验旨在比较scrt联合卡瑞利珠单抗和化疗与lcrt联合化疗作为larc围手术期治疗的疗效和安全性。
研究设计
union研究是一项随机、开放的ⅲ期临床试验(nct04928807),研究招募年龄在18~75岁,临床分期为t3-4/n 的直肠腺癌患者,ecog ps评分0或1分,肿瘤下缘距肛缘小于10cm。符合条件的患者按1:1的比例随机分配到卡瑞利珠单抗联合化疗(cam capox)组或化疗(capox)组,并根据临床t分期(≤t3 vs. t4)和n分期(n0 vs. n )进行分层。患者接受scrt(25gy/5f)或lcrt(50.4gy/28f,同步卡培他滨825 mg/m2,bid)治疗,随后分别接受2个周期的卡瑞利珠单抗(200mg iv drip,d1,q3w) capox(奥沙利铂130 mg/m2 iv drip d1,卡培他滨1000 mg/m2,bid,d1-14,q3w)或capox,后续进行全直肠系膜切除术(tme)。术后cam capox组进行6个周期的卡瑞利珠单抗 capox,和卡瑞利珠单抗单药治疗(总治疗时长不超过一年),capox组进行6个周期的capox。
主要终点是病理完全缓解率(pcr)。关键次要终点为3年无事件生存率(3y-efs)和总生存期(os),其他次要终点包括r0切除率、新辅助治疗完成率、3年无病生存率、肿瘤退缩分级、安全性和生活质量等。* bid=每日2次;iv drip=静脉滴注;q3w=每3周1次
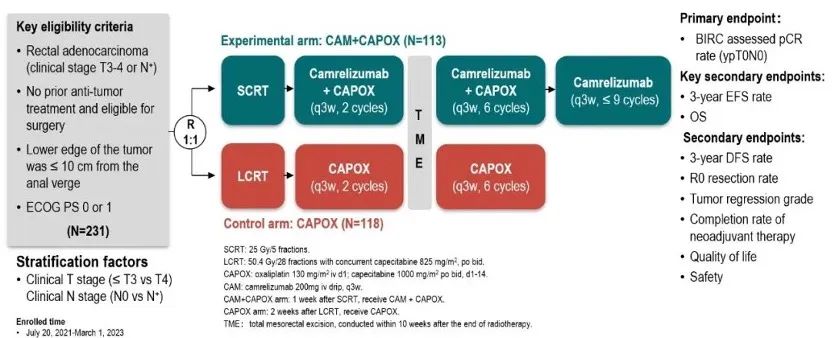
图1.union研究设计
研究结果
2021年7月至2023年3月,共231例患者入组。随机分配至cam capox组(113例)和capox组(118例)。cam capox组中112例患者接受了scrt, 107例完成新辅助治疗,104例接受了手术。capox组115例接受了lcrt,109例完成新辅助治疗,99例接受了手术。
意向治疗(itt)人群中盲态独立审查委员会(birc)评估的pcr率,cam capox组(39.8% [95% ci,30.7-49.5])与capox组相比 (15.3% [95% ci,9.3-23.0])显著提高(or=3.7 [95% ci,2.0-6.9],p<0.001),达到主要终点(图2)。亚组分析显示,各亚组与主分析结果一致(图3)。
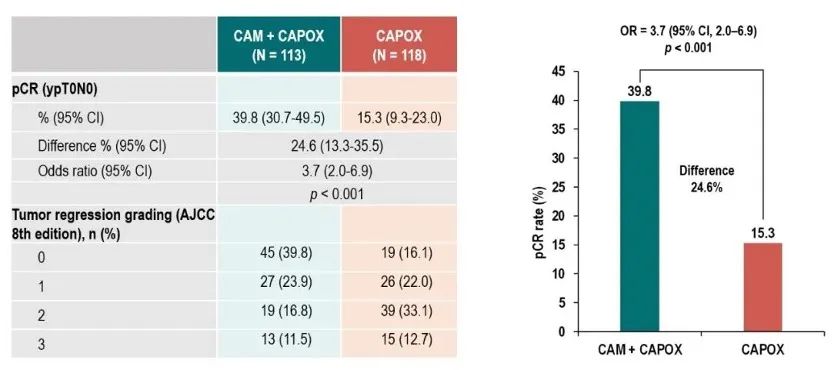
图2. birc评估的pcr率(itt)
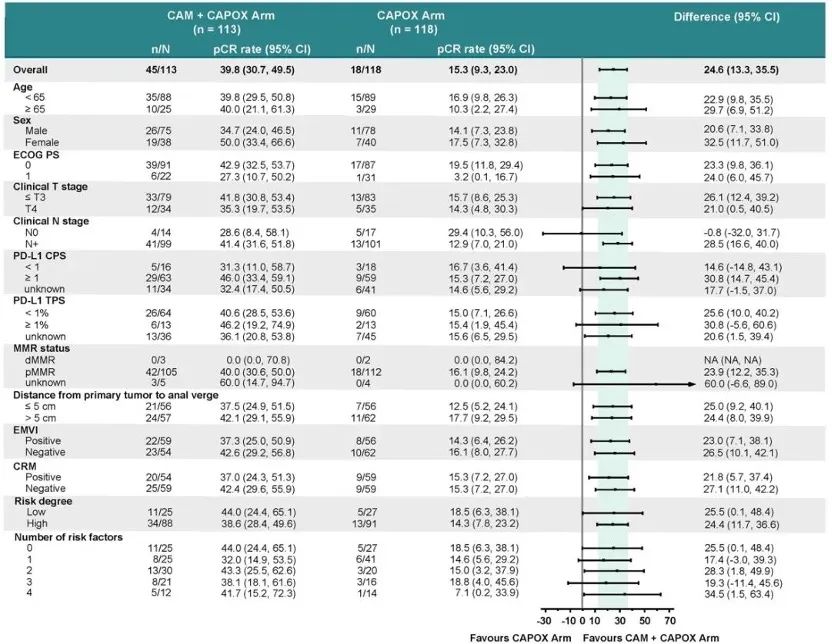
图3. 亚组中pcr率(birc评估)差异的森林图
cam capox组的中位肿瘤退缩率达到98%,capox组为85%(图4)。
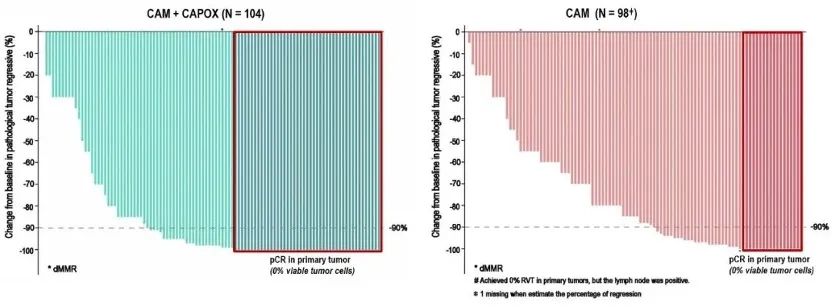
图4. 原发肿瘤病理退缩情况(birc评估)
在手术人群中,cam capox组和capox组的r0切除率分别为96.2%和97.0%,保肛率分别为94.2%和89.9%(图5)。
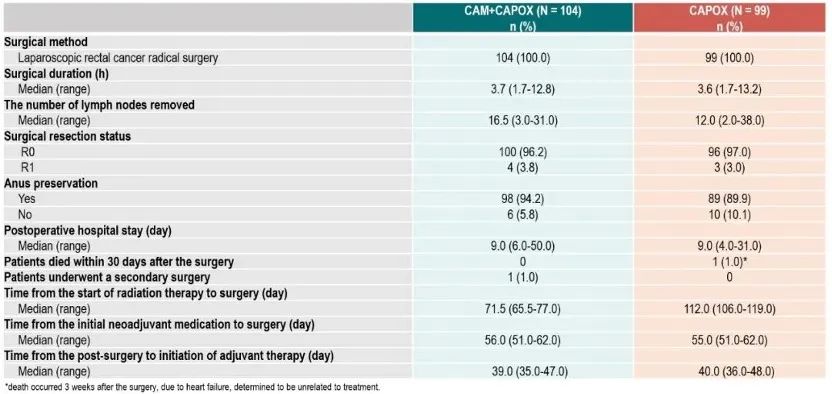
图5.手术结果
union研究是全球首个评估scrt序贯免疫治疗联合化疗治疗larc的ⅲ期研究。cam capox组的pcr率显著优于capox组,达到了主要终点。cam capox组表现出可耐受的安全性,新辅助治疗不影响手术的可行性。scrt序贯卡瑞利珠单抗联合化疗可推荐为larc患者的围手术期治疗方式。该研究的3y-efs率和os数据尚未成熟,目前试验仍在进行中,期待后续更新数据的揭晓!
卡瑞利珠单抗是恒瑞医药自主研发的一款人源化pd-1单克隆抗体,于2019年5月获国家药品监督管理局(nmpa)批准上市,目前已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤种中获批了9个适应症,其中8个适应症已纳入国家医保目录,为获批适应症和覆盖瘤种数量领先的国产pd-1产品。目前,恒瑞医药仍在推进卡瑞利珠单抗在多个瘤种的临床研究,努力为长久以来面临治疗困境的患者带去新选择、新希望。
未来,恒瑞医药将继续坚持“以患者为中心”的理念,在聚焦未获满足的临床需求基础上,针对中国高发肿瘤领域持续推进创新研发,力争研制出更多更好的新药、好药,服务健康中国,惠及全球患者。