新闻速递
2024-06-25
恒瑞创新药shr-1701研究成果荣登《cancer cell》,有望为不可切ⅲ期非小细胞肺癌患者治疗带来新选择
6月20日,由吴一龙教授团队牵头,恒瑞医药自主研发的pd-l1/tgf-βrii双抗shr-1701联合或不联合化疗新辅助治疗不可切除的ⅲ期非小细胞肺癌的概念验证2期临床研究(trailblaze研究)成果,正式全文在线发表于国际权威学术期刊《cancer cell》(影响因子50.3)。trailblaze研究结果显示1,在接受新辅助联合治疗的主要队列患者(n=97)中,两项主要终点均达到,诱导后的客观缓解率(orr)为58% (95% ci 47 ~ 68),18个月无事件生存率(efs)为56.6%(95% ci 45.2 ~ 66.5)。27例(25%)患者接受了手术治疗,均达到r0切除,其中,主要病理缓解(mpr)为44%,完全病理缓解(pcr)为26%;手术治疗组18个月efs率为74.1% (95% ci 53.2 ~ 86.7),放疗组18个月efs率为57.3%(43.0 ~ 69.3)。在不可切除的ⅲ期非小细胞肺癌(nsclc)患者中,新辅助shr-1701联合化疗(随后进行手术或放疗)显示出具有前景的疗效和可耐受的安全性。在相当比例的患者(四分之一)中,手术转化是可行的,并且与较好的生存结局相关。

研究背景
基于免疫(io)的诱导治疗提高了肿瘤/淋巴结降期率、完全切除率和微转移监测率,为无驱动基因突变的可切除nsclc的有效治疗提供了希望2。放化疗后的巩固治疗是目前不可切除的ⅲ期nsclc的标准治疗3,4。我们假设添加新辅助io可能会进一步改善预后:1. 新辅助io的手术转化可能是可行的;2. 手术转化有可能转换为长期生存获益。shr-1701是一种靶向pd-l1和tgf-β的新型双功能融合蛋白5,6。我们开展了一项概念验证试验,在未经治疗的不可切除ⅲ期nsclc中评估了新辅助shr-1701联合或不联合化疗,以及随后的手术或放疗结果。
研究设计
trailblazer是一项在中国20家医疗中心开展的开放标签、2期试验。患者纳入标准如下:年龄18~70岁,患组织学/细胞学确诊的ⅲ期nsclc(根据ajcc第8版),并且mdt(至少一名胸外科医师、一名放射科医师和一名肿瘤内科医师)认为手术不可切除。在这项2期试验(nct04580498)中,mdt评估为手术不可切除的ⅲ期nsclc接受了新辅助shr-1701联合或不联合化疗,随后接受了手术或放疗治疗,然后shr-1701巩固治疗。主要研究终点为诱导后orr和18个月efs率。a b组(接受新辅助免疫 化疗的患者)是主要分析队列。
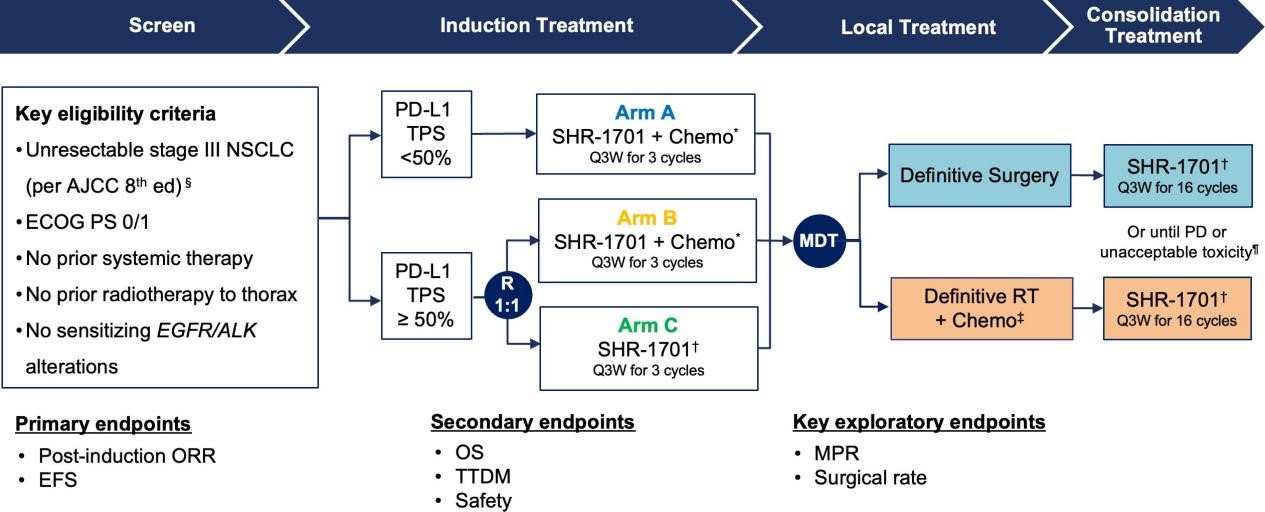
图1 研究设计7
§如果可以采用根治性手术(无需全肺切除即可达到r0切除)和系统性淋巴结清扫,则认为该疾病可切除;不可切除n疾病的推荐标准:认为不可能进行大范围、多站或完全切除。*shr-1701(30 mg/kg,d1) 紫杉醇(175 mg/m2,d1) 卡铂(auc 5,d1)。†shr-1701 (30 mg/kg) 。‡rt (60 gy/30次) 同步顺铂(30 mg/m2,qw). ¶如果研究者认为有临床益处,则允许在进展后进行治疗。
研究结果
1. 患者基线特征
从2020年11月20日至2022年1月27日,107例患者被分配接受shr-1701联合化疗的新辅助治疗(a组,88例;b组,n=9)或新辅助shr-1701单药治疗c组(n=10)(见研究设计图)。a b组(主要分析队列)达到了计划的样本量,但探索性c组未达到计划的样本量。纳入的所有患者均接受了治疗,并被纳入疗效和安全性分析。大多数患者为男性(94%),当前吸烟者或既往吸烟者(90%),鳞状细胞癌(74%)。大多数患者在基线时表现为ⅲb期(44%)/ⅲc期(30%);18%的患者pd-l1 tps≥50%。(表1)
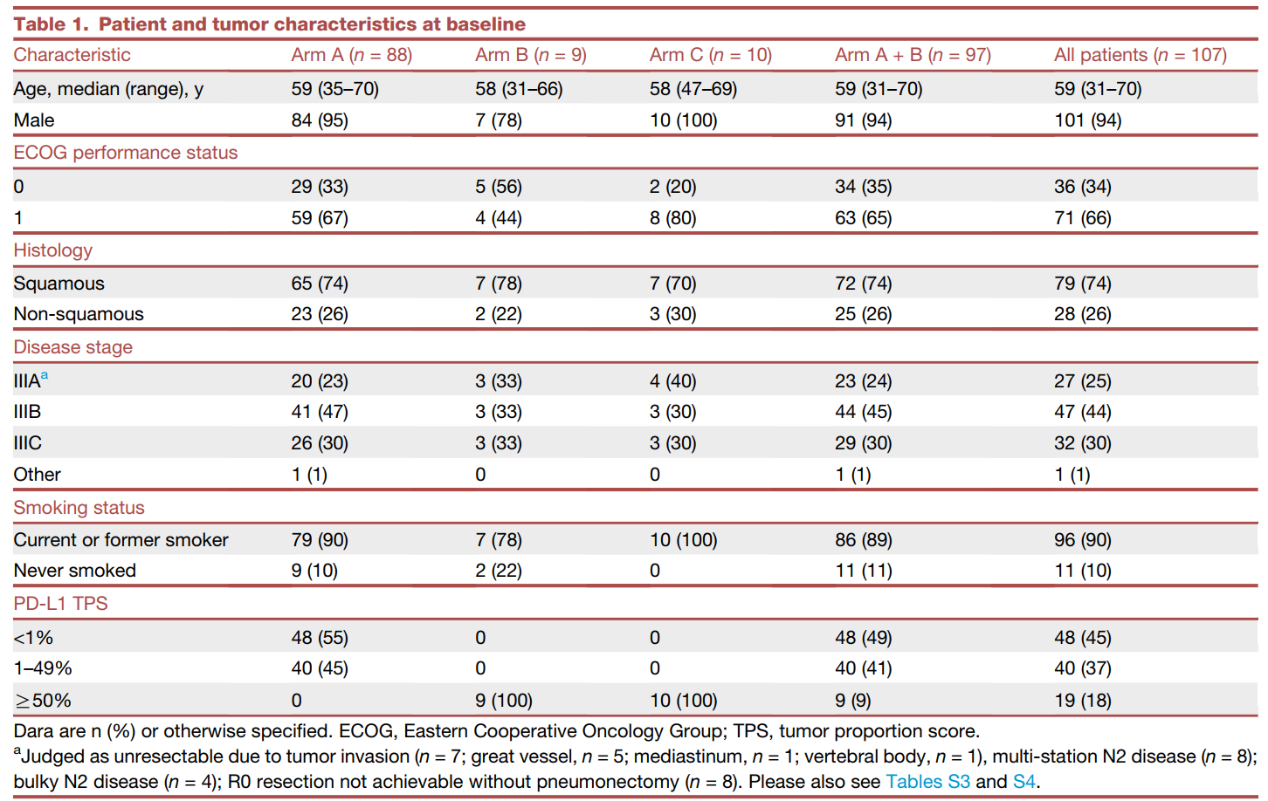
表1 患者基线特征
截至2023年9月30日,中位随访时间为22.2个月。107例患者中,99例(93%)完成诱导治疗,86例(80%)随后接受了局部治疗(手术,n=27;放疗,n=59)。
2. efs与肿瘤缓解
在主要终点分析中,56例(58%;95% ci 47~68)患者在诱导治疗后达到客观缓解,包括1例(1%)完全缓解和55例(57%)部分缓解(表2)。18个月无事件生存(efs)率为56.6% (95% ci 45.2~66.5;图2a)。a b组达到了诱导后orr和efs这两项主要终点。c组中,4例(40%;95% ci 12~74)患者达到诱导后缓解(均为部分缓解)(表2);2例(20%)发生efs事件,18个月efs率为77.1% (95% ci 34.5~93.9)(图2b)。
在所有治疗组中,诱导治疗后的orr为56% (95% ci 46~66), 18个月efs率为58.3% (95% ci 47.4~67.7)(表2,图2c)。诱导后a b组的疾病控制率(dcr)为93%(95%ci 86~97),c组为90%(95%ci 56~100),所有患者的dcr为93%(95%ci 86~97)(表2)。
数据截止时,a b组中位efs为24.2个月(95% ci 12.0~未达到[nr]),c组为未达到;所有患者的中位efs为24.4个月(95% ci 14.0~nr);12个月efs率分别为60.5% (95% ci 49.1~70.1)、90.0% (95% ci 47.3 ~ 98.5)和63.0% (95% ci 52.2~72.0)(图2a-c)。a b组12个月和24个月的总生存率(os)分别为86.8%(95%ci 77.9~92.3)和78.3%(95%ci 68.0~85.7),所有患者的12个月和24个月os率分别为87.9%(95%ci 79.6~92.9)和79.9%(95%ci 70.2~86.8)。
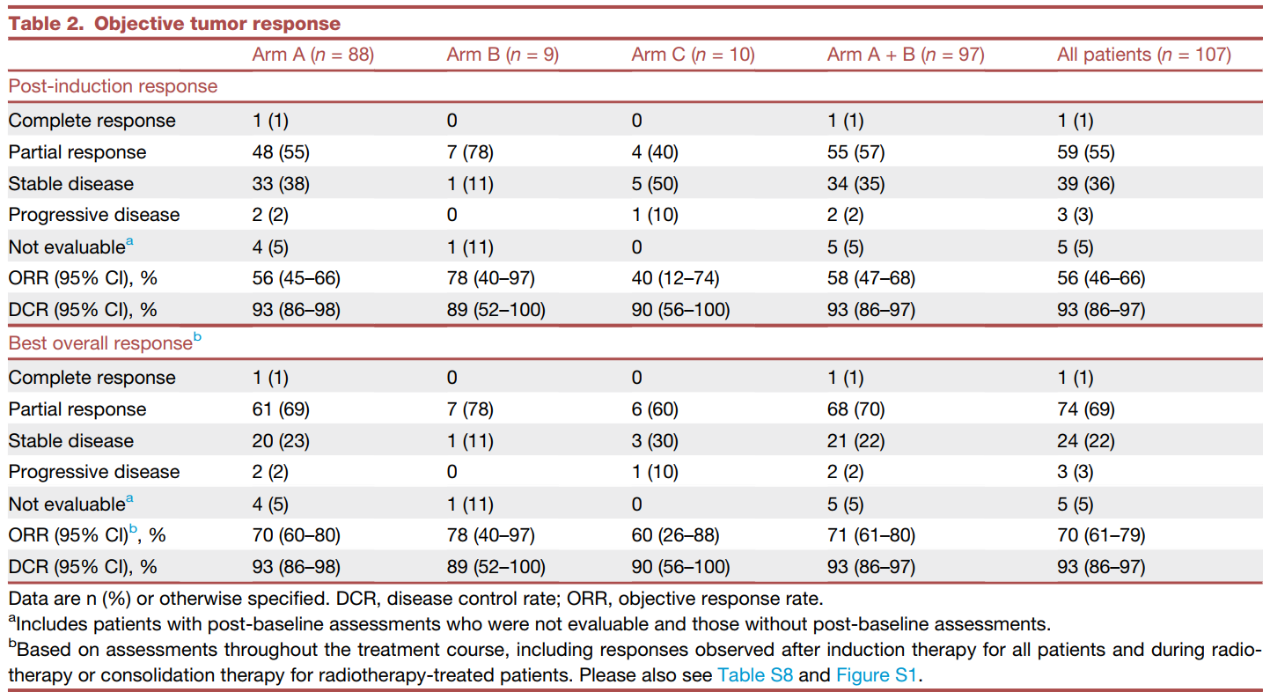
表2 肿瘤客观缓解
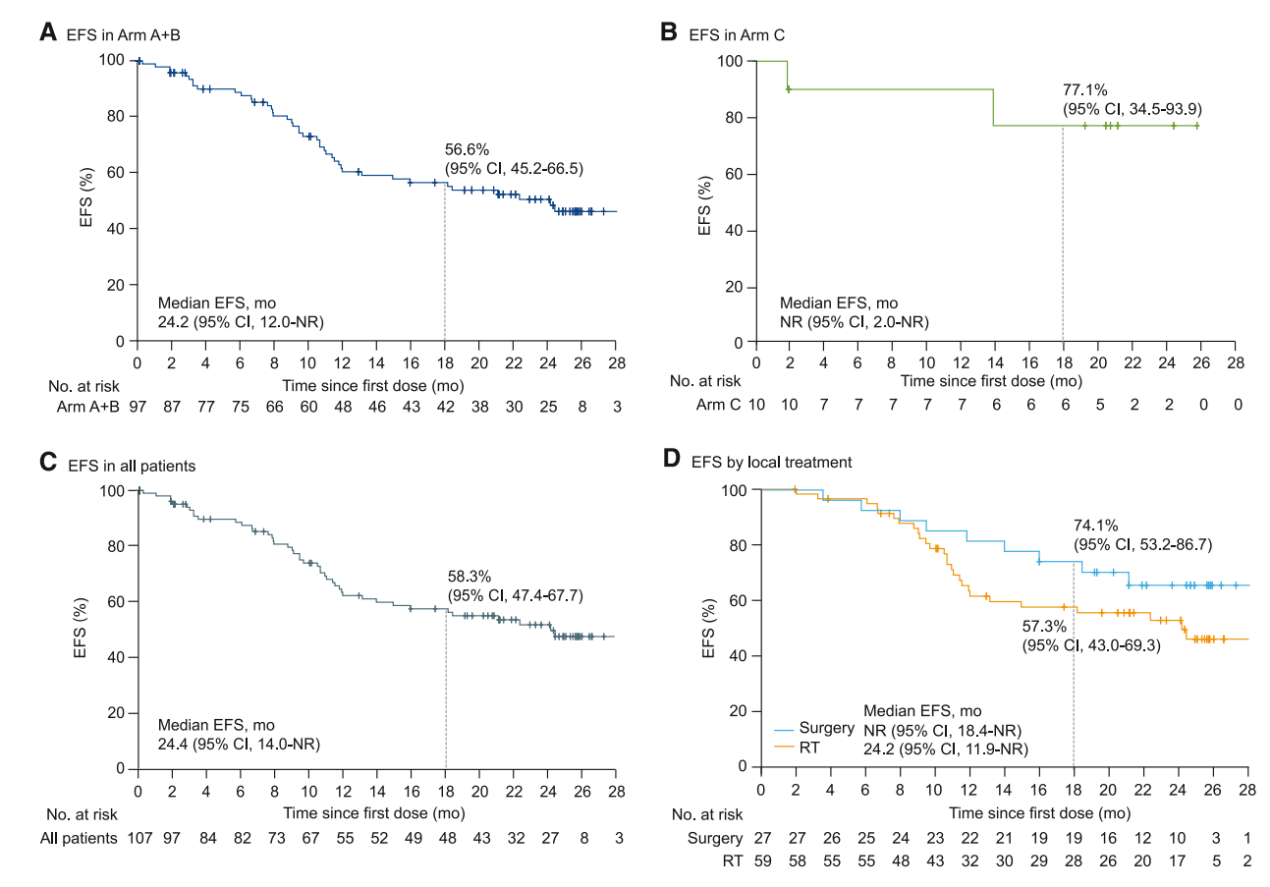
图2 efs kaplan-meier分析
3. 手术结果
107例患者中有27例(25%)接受了手术,a b组和c组的手术转化率分别25%(24/97)和30%(3/10);基线分期为ⅲa期、ⅲb期和ⅲc期的患者中,手术转化率分别37%(10/27)、26%(94/47)和16%(5/32)。手术切除的27例患者均达到r0切除,12例(44%)为主要病理缓解(mpr)和7例(26%)为完全病理缓解(pcr)(图3)。
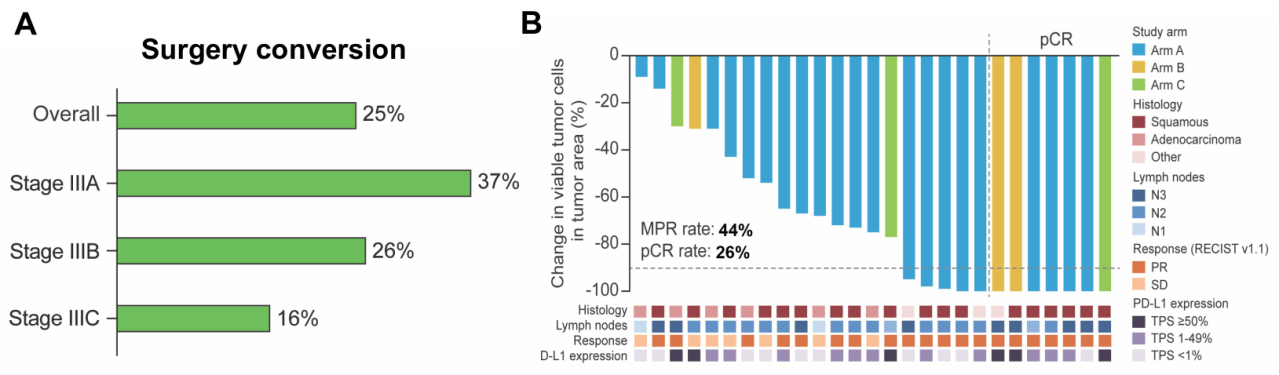
图3 手术转化和病理缓解结果
手术切除患者中位efs未达到(95% ci 18.4~nr),放疗患者中位efs为24.2个月(95% ci 11.9~nr);12个月efs率分别为81.5%(95% ci 61.1~91.8)和61.3%(95% ci 46.9~72.8),18个月efs率分别为74.1%(95% ci 53.2~86.7)和57.3%(95% ci 43.0~69.3)(图2d)。
4. 安全性
安全性结果显示,没有出现新的安全信号,总体不良反应安全可耐受。
研究结论
在不可切除的ⅲ期nsclc中,新辅助shr-1701联合化疗(随后进行手术或放疗)显示出有前景的抗肿瘤活性,并且安全性可耐受。研究证实1/4的患者实现了手术转化,并转化为较好的生存结局。
参考文献:
1. qing zhou, et al. neoadjuvant shr-1701 with or without chemotherapy in unresectable stage iii non-small-cell lung cancer: a proof-of-concept, phase 2 trial. cancer cell. published:june 20, 2024. doi:https://doi.org/10.1016/j.ccell.2024.05.024.
2. mountzios giannis, et al. immune-checkpoint inhibition for resectable non-small-cell lung cancer - opportunities and challenges. nat rev clin oncol.. 20,10 (2023): 664-677. doi:10.1038/s41571-023-00794-7
3. antonia scott j, et al. durvalumab after chemoradiotherapy in stageⅲ non-small-cell lung cancer. n engl j med. 377,20 (2017): 1919-1929.
doi:10.1056/nejmoa1709937
4. qing zhou, et al. sugemalimab versus placebo after concurrent or sequential chemoradiotherapy in patients with locally advanced, unresectable, stageⅲ non-small-cell lung cancer in china (gemstone-301): interim results of a randomised, double-blind, multicentre, phase 3 trial. lancet. oncol. 23,2 (2022): 209-219. doi:10.1016/s1470-2045(21)00630-6
5. dan liu, et al. bifunctional anti-pd-l1/tgf-βrii agent shr-1701 in advanced solid tumors: a dose-escalation, dose-expansion, and clinical-expansion phase 1 trial. bmc med. 20,1(2022): 408. doi:10.1186/s12916-022-02605-9
6. ji-feng feng, et al. shr-1701, a bifunctional fusion protein targeting pd-l1 and tgfβ, for recurrent or metastatic cervical cancer: a clinical expansion cohort of a phase i study. clin cancer res. 28,24 (2022): 5297-5305.
doi:10.1158/1078-0432.ccr-22-0346
7. yi-long wu, et al. j clin oncol 42, 2024 (suppl 16; abstr 8082) . doi:10.1200/jco.2024.42.16_suppl.8082
声明:
1. 本新闻旨在分享研发前沿资讯,仅供医疗卫生专业人士基于学术目的参阅,非广告用途。
2. 恒瑞医药不推荐任何未被批准的药品、适应症的使用。